Si l'on examine un sable fluviatile dans la partie amont du bassin versant d'une zone où affleurent des granites (30 à 50% plagioclases, 5 à 35% FK, 5 à 10% quartz), on constatera paradoxalement que le quartz en est un minéral essentiel. Dans la partie aval du système fluviatile, il peut même être pratiquement seul. C'est l'altération qui est responsable de l'augmentation de la proportion de quartz (minéral résistant) dans les sédiments. En effet, les silicates de haute température (péridots, pyroxènes, plagioclases calciques...) sont vulnérables à l'altération car l'arrangement des tétraèdres de silice est peu organisé (néso- , soro- inosilicates).. Les minéraux de moyenne et basse température (inosilicates à deux chaînes, phyllo- et tectosilicates) sont plus résistants. Les verres, amorphes car figés à très haute température, sont les plus vulnérables. Donc, la vulnérabilité à l'altération des minéraux issus de la cristallisation d'un magma décroît proportionnellement à l'ordre de cristallisation précisé, entre autres, dans les séries réactionnelles de Bowen (autre manière d'exprimer les choses...). Dans le cas du quartz, il faut ajouter le fait que ce minéral possède aussi une bonne résistance aux chocs car il ne se clive pas.
L'altération a pour effet de décomposer une roche en (1) des ions solubles et des grains qui vont être mobilisés par l'érosion d'une part et (2) un dépôt résiduel d'autre part, demeurant sur place.
Les mécanismes responsables de l'altération, phénomène prenant place aux températures et pressions "faibles" régnant à la surface de la terre, sont l'altération physique, l'altération biologique et l'altération chimique.
1. L'ALTERATION PHYSIQUE
Les processus mis en oeuvre dans l'altération physique sont les suivants:
- les alternances de gel-dégel, en climat suffisamment humide, fragmentent les roches (cryoclastie). L'eau en gelant augmente son volume de 9-10% et agit comme un coin, élargissant progressivement les fractures;
- les variations répétées de température (40-50°C d'amplitude journalière dans le Sahara) ont aussi le même effet que le gel: les différences de dilatation thermique entre les minéraux d'une roche provoquent l'apparition de fractures;
- la cristallisation de sel ou d'autres minéraux évaporitiques peut également élargir les fissures des roches (haloclastie);
- la décompression survient lorsque des roches ayant subit un enfouissement sont libérées de la pression lithostatique par enlèvement des formations surincombantes. Des joints de décompression, pratiquement parallèles à la surface du sol se développent progressivement.
- l'usure mécanique par des grains détritiques emportés par le vent, l'eau, la glace.


2. L'ALTERATION BIOLOGIQUE
On distingue l'altération provoquée par l'action chimique de composés produits par des organismes (plantes, microbes,...) de l'action purement mécanique de plantes ou d'animaux (par exemple: dilatation progressive des racines jouant le rôle de coin dans des fractures de roches). L'ingestion de matériaux par des animaux vivant dans les sols est un processus faisant intervenir en même temps les deux types de mécanismes cités.
Un premier processus important est l'oxydation de la matière organique (par la fermentation ou la respiration), produisant de l'eau et du CO2, lui-même impliqué dans des réactions de mise en solution:
C6H12O6+ 6 O2 -> 6 CO2+ 6 H2O
La combinaison du CO2 et de l'eau donne naissance à l'acide carbonique (H2CO3), un acide faible qui peut néanmoins solubiliser la calcite (ou un autre carbonate):
H2CO3+ CaCO3 -> Ca++ + 2 HCO3-
On a en effet observé que pour une concentration de CO2 équivalente à la concentration atmosphérique (~3.10-4 atm), la concentration de Ca++ et HCO3- était de respectivement de 20 mg/l et 60 mg/l. Dans un sol où la concentration de CO2 peut atteindre 3.10-2 atm, les concentrations respectives de Ca++ et HCO3- peuvent augmenter jusqu'à 90 mg/l et 260 mg/l.
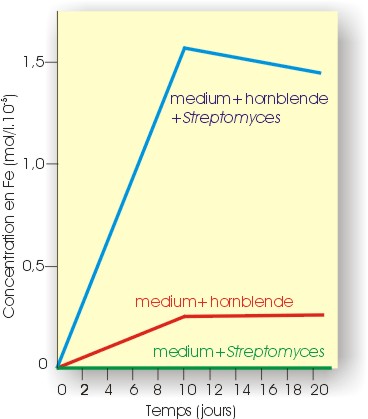
L'action des microorganismes est importante et ne se limite pas à la production de CO2. Dès leur arrivée en subsurface, les minéraux des roches sont soumis à leur métabolisme. Des colonies microbiennes croissent à leur surface, s'infiltrent dans les fractures à la recherche d'éléments essentiels à la vie. L'altération microbienne se manifeste surtout sous la forme d'une dissolution par des acides organiques dont le plus fréquent est l'acide oxalique. L'attaque des minéraux par ces acides libère des cations métalliques qui, combinés aux anions organiques donneront naissance à des complexes organo-métalliques (dans le cas des oxalates, combinés au calcium issu de la dissolution des carbonates, cela donnera naissance à CaC2O4, fréquent dans les sols). Beaucoup de microbes possèdent la faculté de produire des molécules spécifiques en fonction du type de minéral à dégrader. L'exemple de la Fig. II.1 montre la mise en solution du fer à partir de hornblende par des bactéries.
Outre l'action des acides organiques, la formation de biofilms d'EPS ("exopolymeric substances" ou polymères extracellulaires) maintient une hydratation constante autour des minéraux qui favorise les réactions de mise en solution.
Ces processus d'altération microbienne par dissolution de minéraux primaires et précipitation de nouveaux minéraux d'origine biogénique (comme l'oxalate de calcium) modifient l'aspect de la roche et méritent le nom de diagenèse microbienne. Cette diagenèse particulière se marque souvent par la précipitation de microcristaux en remplacement de cristaux plus grands. C'est le processus de micritisation dans le cas des carbonates, fréquent en particulier dans les sols.
3. L'ALTERATION CHIMIQUE
L'altération chimique agit de deux façons: certains minéraux (halite, calcite) sont dissous totalement et leurs ions sont évacués en solution. D'autres minéraux, comme les micas ou les feldspaths sont transformés en d'autres espèces minérales (surtout en argiles), souvent de granulométrie plus fine et plus facilement mobilisables par l'érosion. La plupart des réactions impliquées dans l'altération nécessitent la présence d'eau et d'air. Passons en revue les réactions les plus significatives.
3.1. Principales réactions chimiques impliquées dans l'altération
- mise en solution: c'est la réaction la plus simple, faisant intervenir de l'eau, ou un acide. Envisageons quelques cas concrets:
- la solubilité du quartz est très faible (6 ppm dans les eaux de surface); la réaction de mise en solution est la suivante: SiO2 + 2 H2O -> H4SiO4
- la calcite, par contre est beaucoup plus soluble, parce que que l'eau de pluie se charge en CO2 et agit comme un acide faible lors de sa mise en contact avec la calcite (environ 2000 ppm). La réaction est la suivante: CaCO3 + H2O + CO2 -> Ca+++ 2 HCO3- (bicarbonate en solution).
- la halite et les autres halogénures sont très solubles (solubilités de l'ordre du millier de ppm).
- hydratation et déshydratation, ou de manière plus concrète: minéral+eau=nouveau minéral hydraté; la déshydratation étant le processus inverse. Les réactions les plus importantes sont:
- la déshydratation du gypse pour produire de l'anhydrite: CaSO4.2H2O -> CaSO4+ 2 H2O;
- l'hydratation de l'hématite pour produire de la limonite: Fe2O3+ 3 H2O -> 2 Fe(OH)3;
- l'hydratation de la kaolinite pour produire de la gibbsite.
- hydrolyse. Cette réaction est le processus par lequel un cation d'un minéral est remplacé par le H+ d'une solution acide. Cette réaction a pour conséquence de détruire le minéral (mise en solution complète) ou de le convertir en une nouvelle espèce. A titre d'exemple, l'olivine et le pyroxène se dissolvent complètement, alors que les feldspaths se dissolvent partiellement, produisant de la silice en solution et des minéraux argileux. Comme les eaux météoriques contiennent du CO2 dissout, les réactions se présentent comme suit:
- Mg2SiO4 (forstérite) + 4 H2 CO3 -> 2 Mg++ + 4 HCO3- + H4SiO4
- 4 NaAlSi3O8 (albite) + 4 H2 CO3 + 18 H2O -> 4 Na+ + 8 H4SiO4 + Al4Si4O10(OH)8 (kaolinite) + 4 HCO3-
(Remarque: ces réactions d'altération des minéraux silicatés sont donc des "pompes" à CO2 atmosphérique!)
- oxydation-réduction. Le processus d'oxydation le plus connu est la transformation de Fe2+ en Fe3+; le Mn se comporte de la même manière que le fer, avec la pyrolusite (MnO2) et la manganite (Mn2O3.H2O) comme principaux produits d'oxydation.
- (Fe2+)2SiO4+ 1/2 O2+ 5 H2O -> 2 Fe3+(OH)3 + H4SiO4
- 4 FeS2+ 15 O2 + 8 H2O -> 2 Fe2O3+ 8 H2SO4
| constituants solubles | Na+, Ca2+, K+, Mg2+, H4SiO4, HCO3-, SO42-, Cl- |
| minéraux résiduels | quartz, zircon, magnétite, ilménite, rutile, grenat, sphène, tourmaline, monazite |
| minéraux néoformés | kaolinite, montmorillonite, illite, chlorite, hématite, goethite, gibbsite, boehmite, diaspore, silice amorphe, pyrolusite |
| constituants organiques | acides organiques, acides humiques, kérogène |
Tableau II.1: produits les plus courants de l'altération chimique.
3.2. Les paramètres qui contrôlent l'altération chimique
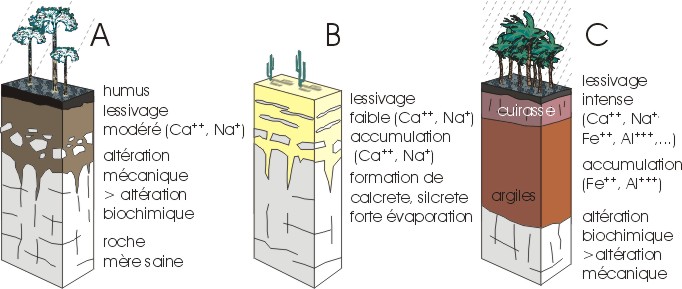
Le climat est probablement le facteur le plus important dans le contrôle de l'altération chimique. Si l'on considère en effet l'aspect cinétique des réactions chimiques, il est clair qu'une température élevée va les favoriser. L'humidité est également importante, puisque beaucoup de réactions se passent en milieu aqueux. L'altération chimique est donc prééminente en climat chaud et humide. En climat froid, même si les précipitations sont abondantes, l'eau est à l'état de neige ou de glace, favorisant plutôt l'altération physique (Fig. II.2). D'autres facteurs occupent également une place importante, quoique plus indirecte: c'est par exemple le cas du drainage. Si les ions mis en solution ne sont pas évacués, un équilibre chimique sera atteint et les réactions d'altération vont s'arrêter. Le relief, également, contrôle la pente des réseaux fluviatiles et la rapidité des courants, donc l'intensité de l'évacuation des ions: on a pu montrer par exemple que pour des circulations faibles, l'albite est transformée en kaolinite, alors qu'avec une circulation plus rapide, elle est transformée en gibbsite (car l'acide silicique est évacué).
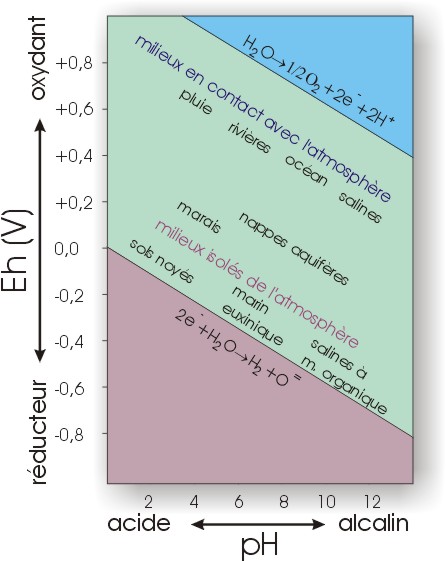
L'acidité-alcalinité et le degré d'oxydo-réduction des eaux sont également des paramètres importants contrôlant l'altération chimique. Si l'on porte en graphique l'Eh en fonction du pH pour des environnements naturels variés (Fig. II.3), on constate que l'eau pluviale est légèrement acide, tout comme les sols. Ce sont donc deux environnements où dissolution et hydrolyse vont jouer un rôle dominant. Par contre, le pH de l'eau de mer est de l'ordre de 8: peu de réactions d'hydrolyse ont donc lieu en milieu sous-marin. On observe aussi que la plupart des environnements en contact avec l'atmosphère sont oxydants. Des conditions réductrices ne sont observées que dans des milieux isolés de l'atmosphère (bassins stratifiés, nappes profondes,...) ou des milieux dont tout l'oxygène est consommé (par exemple suite à l'oxydation de la matière organique).
3.3. Exemple: l'altération des roches magmatiques
Ces roches sont en déséquilibre thermodynamique lors de leur arrivée à l'affleurement. Il s'agit généralement de roches polyminérales et leur sensibilité à l'altération est fonction à la fois de l'altérabilité des différents minéraux et de la structure de la roche. A sensibilité égale des minéraux, les roches à gros grains (pegmatites) sont plus vulnérables que les roches à grains fins (aplites).
L'altérabilité des minéraux constituants des roches magmatiques est en fonction inverse de leur ordre de cristallisation dans les magmas. Cette relation est également présente dans le groupe des feldspaths, où l'orthose est peu altérable, alors que les plagioclases le sont plus. Au sein des plagioclases, la sensibilité à l'altération augmente de l'albite à l'anorthite.
Prenons l'exemple des réactions mises en jeu lors de l'altération de l'orthose:
- les premiers stades de l'altération de l'orthose aboutissent à la formation de minéraux argileux, l'illite, ou si le drainage est mauvais, les smectites:orthose + eau -> illite + silice + potassium (entraîné en solution)Ce processus est appelé bisiallitisation car le rapport Si/Al (égal à 3 dans l'orthose) est de 2 dans l'illite;
- en cas de lessivage plus important de la silice (altération plus poussée), on obtient de la kaolinite ou le rapport Si/Al est de 1. Il s'agit du processus de monosiallitisation;
- enfin, dans le stade ultime (climat tropical humide), toute la silice est lessivée et il ne subsiste qu'un hydroxyde d'aluminium, la gibbsite, dans laquelle le rapport Si/Al est égal à zéro. Ce processus est appelé allitisation et aboutit à la formation de bauxites mais, comme le plus souvent le produit d'altération contient du fer, on parle de ferrallitisation ou de latérisation.

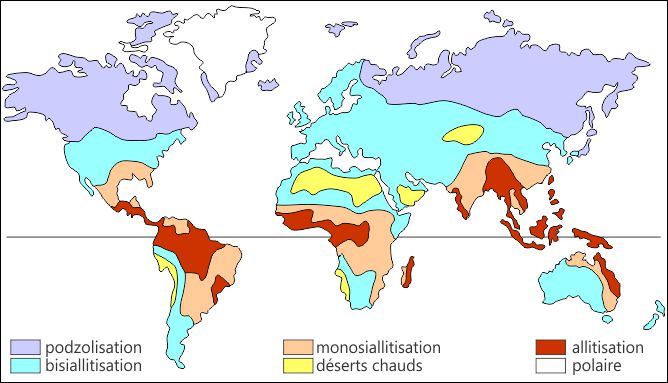
3.4. Exemple: le caractère zonal des sols
Un sol comprend une fraction organique résultant de la décomposition de la litière végétale et une fraction minérale provenant de l'altération de la roche mère. Le caractère zonal des sols (Fig. II.4) reflète essentiellement le climat, par l'intermédiaire des profils d'altération évoqués plus haut (cf. Fig. II.2). Les sols allitisés s'observent en zones équatoriale et tropicale humide, les sols monosialitisés en zone aride et les sols bisialitisés dans des régions où l'altération chimique est relativement faible (tropicales sèches, tempérées). Les podzols sont des sols acides de régions froides.
Rédigé par Pr Dr Frédéric Boulvain
