1\ Diagramme de concentration.
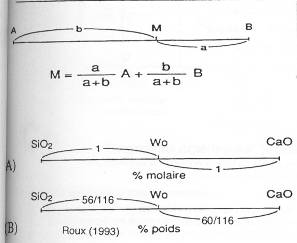
a\ Binaire (SiO3Ca).
SiO3Ca → SiO2 + CaO
Il faut faire attention à respecter les paramètres de « molarité » (stoechiométrique) et de poids.
b\ Ternaire.

2\ Diagramme température/pression.
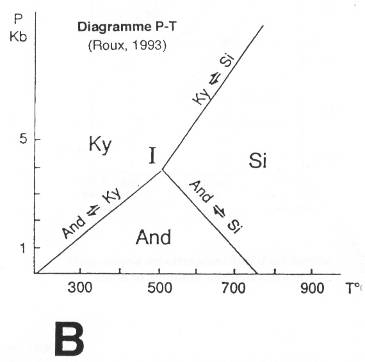
Al2SiO5.
Si on a de l'andalousite, c'est qu'il y a un métamorphisme grâce au magmatisme granitique (grande diffusion de chaleur, <700°C). Si on a de la sillimanite → métamorphisme HT.
3\ Diagramme composition/température.
a\ Binaires.
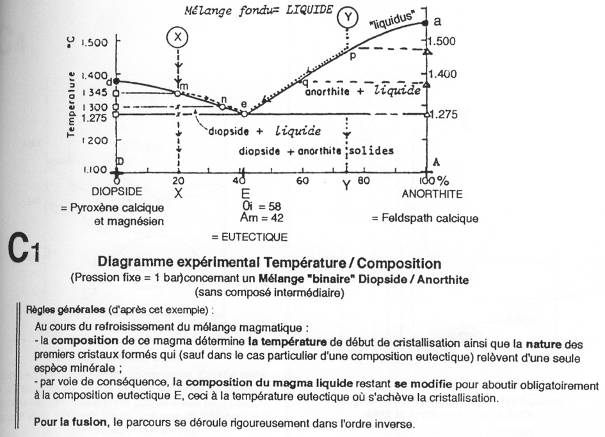
On est dans le cas d’un refroidissement d’un mélange fondu de diopside / anorthite. La courbe du liquidus est avec le point E de l’eutectique. Cette courbe donne pour toutes les températures, la composition du liquide. La courbe du solidus donne pour toutes les températures, la composition du solide.
Entre M et N, le diopside cristallise en premier. Entre N et E, cela continue. Au point E, on trouve donc des cristaux de diopside et du liquide. À ce moment-là, il y a cristallisation simultanée de diopside et d’anorthite. Pendant le refroidissement, le liquide change de composition.
Le refroidissement de mélanges solides (cristaux mixtes).
Revoir le document C1.
Il y a en M1, 55% de Forstérite et 45% de Fayalite.
La température diminue, arrive sur la courbe du liquidus. Le premier cristal qui apparaît est riche en Mg (moins de 20% de fayalite). La température continue à baisser ; pendant la cristallisation, les cristaux réagissent avec le liquide pour réajuster la composition les cristaux ont la même composition que le liquidus de départ (dans l’expérience).
Dans la lave basaltique, cela ne se passe pas pareil : les premiers cristaux sont riches en magnésium (à haute température, HT). Cela provoque un changement de composition du liquide car les premiers cristaux ne réagissent pas avec le liquide (ils sont mis « à part »). À la fin de la cristallisation, les cristaux obtenus seront très riches en Fe.
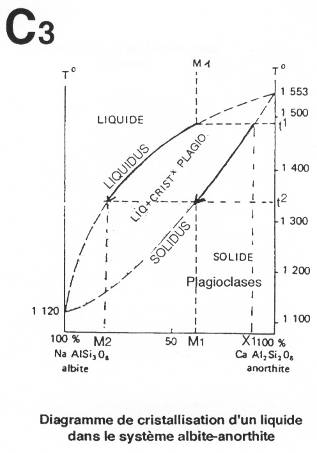
C’est le même système que dans l’exemple précédent pour le refroidissement expérimental.
On obtient un cristal zoné (quand le refroidissement est rapide) avec un cœur calcique et une périphérie sodique.
Insérer document du cahier pour représentation de ce cristal zoné.
Dans le basalte, on retrouve des phénocristaux d’olivine (Mg) et de plagioclase (Ça) et des microlithes de plagioclases (NaCa) mais aussi des microcristaux de fer. C’est une cristallisation en, au moins, deux temps.
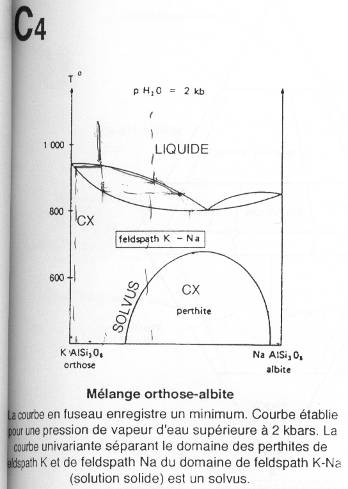
On est dans le cas des feldspaths alcalins (orthose / albite).
La zone du solvus est une zone dans laquelle les cristaux sont mixtes. C’est un mélange des deux cristaux.
Pour un liquide riche en K+, les premiers cristaux seront très riches en K. A la fin, il y aura peu de Na et encore beaucoup de K.
Si le liquide est riche en Na+, ce sera l’inverse : il restera beaucoup de Na et très peu de K.
Lorsque le mélange du solvus arrive à 620°C, le cristal mixte va se séparer en albite et en orthose : ce sont les perthites.
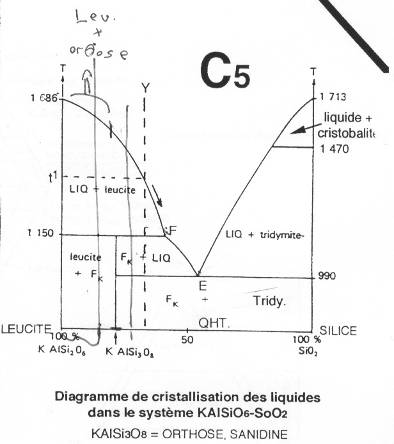
Mélange binaire avec composé intermédiaire. La fusion est incongruente. On trouve de la leucite et de la silice (la leucite est un feldspathoïde). Dans une roche où il y a du quartz on ne trouve jamais de feldspathoïde.
Par rapport à l’orthose, la leucite présente 1 SiO2 de moins. Le composé intermédiaire est l’orthose.
Au point F, on est au prétectique : la cristallisation commence en un point sur le liquidus et finie en E.
- S’il y a beaucoup de leucite, c’est celle-ci qui cristallise en premier. Au point F (1150°C), la leucite et l’orthose cristallisent en même temps. À l’arrivée au point E, on aura un mélange.
- Dans le cas d’un départ du point Y, le premier cristal à apparaître sera la leucite. Le liquide s’enrichit en SiO2. Au point F, il y aura un blocage et la leucite va se résorber. Il y aura alors cristallisation d’orthose. Au point E, la cristallisation sera pour la silice et l’orthose.
Si le départ est entre E et F, on obtiendra de l’orthose puis, à E, de l’orthose et de la silice.
Si on démarre du côté de la silice, leSiO2 va précipiter et au point E il y aura précipitation d’orthose et de silice.
Il y a incompatibilité feldspathoïdes / quartz, dans les roches magmatiques.
Diagramme ACF / A’KF
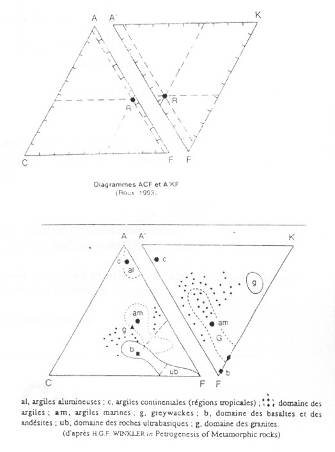
Le pôle A : Al3+ / Fe3+ (alumineux)
Le pôle C : Ca2+ (et Na+)
Le pôle F : Fe2+ / Mg2+.
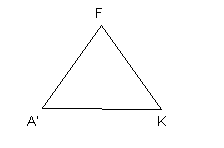
Le pôle A’ : Al3+ / Fe3+
Le pôle F : Fe2+ / Mg2+
Le pôle K : K+
Pour les roches métamorphiques, c’est un bon moyen de les reconnaître, mais qui n’est pas le meilleur.
b\ Ternaire.
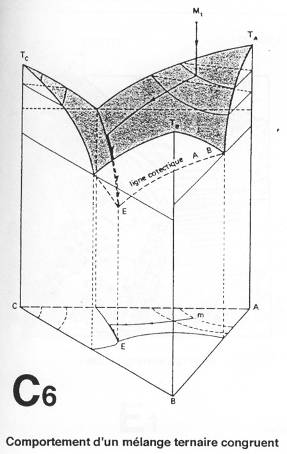
E : point eutectique.
Il y a cristallisation de A ; à l’arrivée sur la ligne cotectique, il y a cristallisation de A et de C. Quand on arrive en E, il y aura cristallisation de A, B et C.