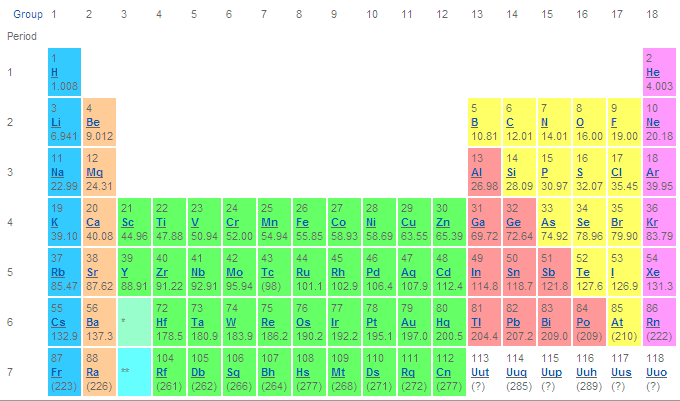
Nous savons tous que les matériaux de notre planète sont constitués d'éléments chimiques, comme l'hydrogène, l'oxygène, le fer, le nickel, etc.... Il y en a 106 dans le tableau périodique des éléments de Mendeleef.
Ces éléments sont formés par des atomes, l'unité de base de la matière. Voici un modèle simplifié de l'atome:
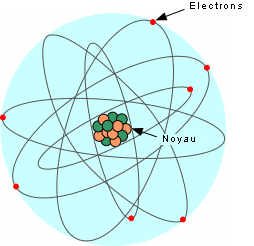
L'atome consiste en un noyau central composé de protons (charges positives) et de neutrons (aucune charge), entouré d'électrons (charge négative) qui gravitent autour du noyau. Toute la masse est concentrée dans le noyau, les électrons ayant une masse négligeable. La masse atomique d'un atome est donc donnée par la masse du noyau, soit le nombre de protons + le nombre de neutrons. Chaque atome possède un numéro atomique qui est donné par le nombre de protons.
Si on monte d'un cran dans l'organisation de la matière, il y a les molécules qui sont formées d'un assemblage d'atomes qui sont liés entre eux par deux principaux types de liens: les liens ioniques et les liens covalents.
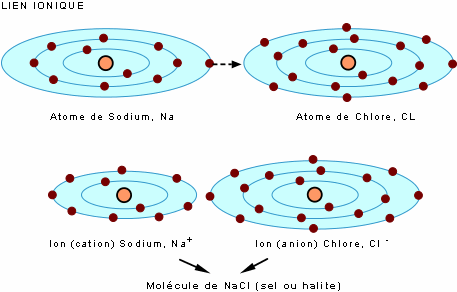
Le lien ionique est assuré par un transfert d'électron(s) d'un atome à l'autre. On présente ici l'exemple du NaCl (sel): le transfert d'un électron du sodium (Na) au chlore (Cl) produit une molécule stable, le chlorure de sodium (NaCl), dans lequel les atomes sont sous leur forme ionique (les ions Na+ et Cl-).
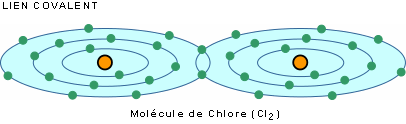
Dans le lien covalent, les atomes s'unissent par partage d'électrons. C'est le cas, par exemple, des gaz hydrogène (H2), Oxygène (O2) et chlore (Cl2).