Un minéral est une substance naturelle de composition chimique et de structure atomique bien définie qui se présente souvent sous forme de cristaux. On connaît 1500 à 1800 espèces minérales. 200 sont relativement connues. On trouve dans ces minéraux 8 éléments chimiques fondamentaux, produisant des assemblages distincts.
1\ Les silicates.
Revoir le document précédent.

a\ Tétraèdre, SiO4, motif ionique élémentaire.
Si est tétracoordonné et forme (SiO4)4-. Ces tétraèdres ne peuvent s'assembler que par les sommets.
b\ Modalités d'assemblage.
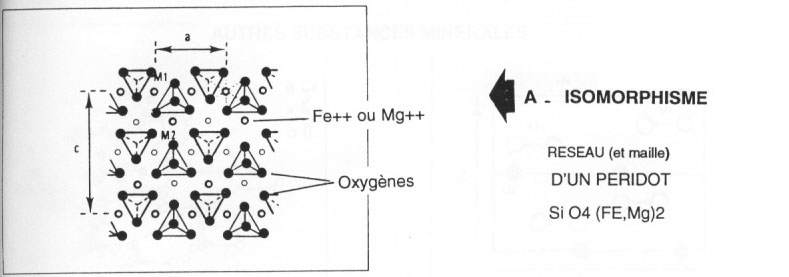
- Les tétraèdres isolés (nésosilicates). Cas des péridots (olivine). Ils ne s'assemblent pas et les charges sont saturées par Fe et/ou Mg. SiO4Mg2 = sforstérite (verte), SiO4Fe2 = fayalite (noire). Mg et Fe sont environ de la même taille. Ce sont des roches volcaniques. La formule est : SiO4(Mg, Fe)2. Ils sont importants pour les phénomènes d'altération par la présence de deux cations. Grenat, zircon, topaze, sphène, andalousite, silimanite et disthène sont dans ce cas.
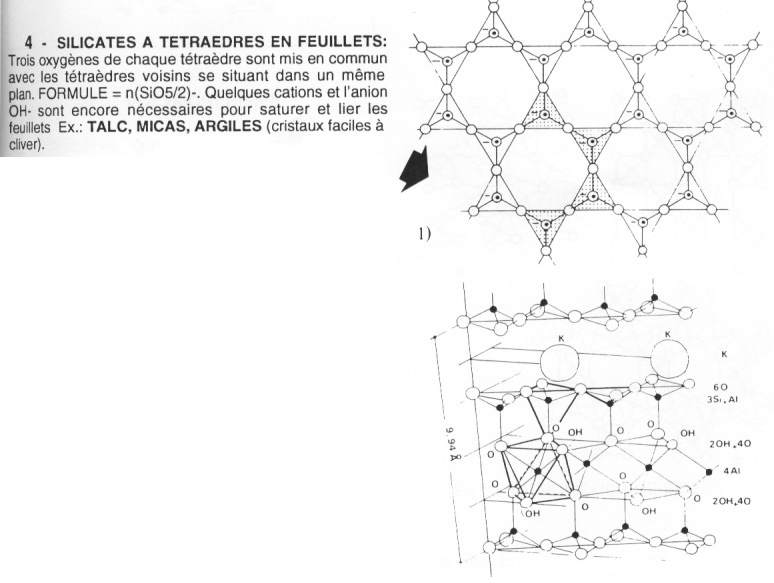
- Les silicates en chaîne ou ruban : les Inosilicates.Chaîne simple (pyroxène) : mise en commun de deux de leurs sommets : SiO32-. La nature du cation détermine la couleur. Ils sont orthorhombiques ou monocliniques, vert sombre ou noirs et trapus.Ruban (amphibole), double chaîne : un tétraèdre sur deux met en commun trois de ses sommets. La formule est (Si4O11)6-. Dans l'hexagone, il y a presque toujours un ion OH-, ce qui donne (Si4O11OH)7-. Si on a Si8O22(OH)2Mg7, ceux-ci sont moins altérables que les « isolés ». Ils forment une aiguille, il y a troncature sur deux angles, Ce sont des roches magmatiques et métamorphiques.Tétraèdres en feuillets (phyllosilicates). Ces tétraèdres mettent en commun trois sommets et dessinent des feuillets hexagonaux de tétraèdres. Leur formule de base est (Si2O5)2-. Pour un hexagone (Si6O15)6-. Dans les phyllosilicates, il y a superposition des feuillets, Des exemples de minéraux de ce type sont le mica noir (biotite, Fe), le mica blanc (muscovite, K). L'aluminium se dispose pour être au centre d'un octaèdre. Les liaisons entre deux groupes se font grâce au K+ au lieu où le clivage est très facile à rompre. On trouve par exemple, le talc, les micas et les argiles.
- Chaîne simple (pyroxène) : mise en commun de deux de leurs sommets : SiO32-. La nature du cation détermine la couleur. Ils sont orthorhombiques ou monocliniques, vert sombre ou noirs et trapus.
- Ruban (amphibole), double chaîne : un tétraèdre sur deux met en commun trois de ses sommets. La formule est (Si4O11)6-. Dans l'hexagone, il y a presque toujours un ion OH-, ce qui donne (Si4O11OH)7-. Si on a Si8O22(OH)2Mg7, ceux-ci sont moins altérables que les « isolés ». Ils forment une aiguille, il y a troncature sur deux angles, Ce sont des roches magmatiques et métamorphiques.
- Tétraèdres en feuillets (phyllosilicates). Ces tétraèdres mettent en commun trois sommets et dessinent des feuillets hexagonaux de tétraèdres. Leur formule de base est (Si2O5)2-. Pour un hexagone (Si6O15)6-. Dans les phyllosilicates, il y a superposition des feuillets, Des exemples de minéraux de ce type sont le mica noir (biotite, Fe), le mica blanc (muscovite, K). L'aluminium se dispose pour être au centre d'un octaèdre. Les liaisons entre deux groupes se font grâce au K+ au lieu où le clivage est très facile à rompre. On trouve par exemple, le talc, les micas et les argiles.
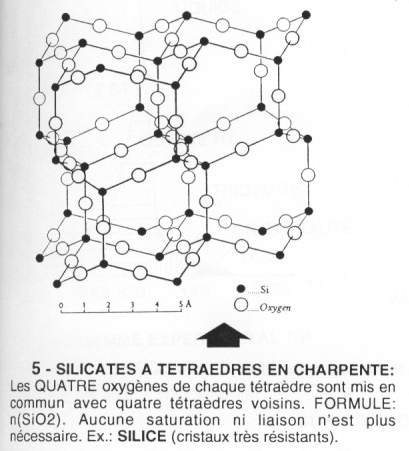
- Les silicates en charpente ou « tectosilicates ». Ces formes mettent en commun 4 sommets. Elles sont très dures. On retrouve, la silice, le feldspath, le quartz. La formule de base est : n(SiO2).
2\ Diversité des substances silicatées.
a\ Isomorphisme. Exemple des péridots.
Définition : même forme mais composition différente. Mg et Fe se remplacent très bien car ils ont à peu près la même taille.
b\ Polymorphisme. Exemple de la silice.
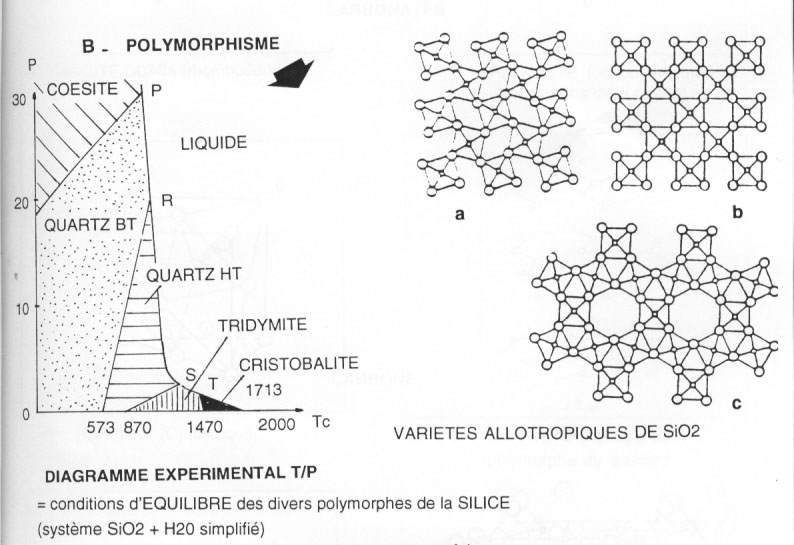

Définition : on retrouve dans ce cas la même composition mais une forme différente.
On peut citer le quartz BT (α) qui est rhomboèdrique alors que le quartz HT (β) est hexagonal. Dans le cas de la tridymite, celle-ci est hexagonale alors que la cristobalite est cubique. La coésite est monoclinique. Toutes les formes citées sont des formes naturelles.
On trouve six domaines de stabilité, séparés par une courbe de transformation (sur la courbe, passage de l'un à l'autre). Dans la limite des domaines, il y a deux degrés de liberté. Sur la courbe, on a les deux polymorphes et il n'y a plus qu'un seul degré de liberté. Les points P, R, S et T, dits invariants, n'ont aucun degré de liberté.
La règle de phase est : v = c + 2 – φ.
« C » est ici pour SiO2 = 1.
« 2 » est un nombre paramètre pouvant changer
« φ » est le nombre de phases de polymorphie.
Quand un polymorphe est dans une roche, on l'utilise comme baromètre et thermomètre géologique. Si on se trouve sur un point invariant, on aura « précisément » la température et la pression. La roche sera dite « roche index ».
c\ Substitution (Si par Al).
Il existe trois règles.
- Pour que deux ions puissent se remplacer dans un cristal, il faut que leur rayon ionique soient différents de moins de 15%.
- Lorsque deux ions ont la même charge électrique et des rayons ioniques différents (comme Na+ et K+), c'est celui qui a le PLUS PETIT rayon qui sera incorporé.
- Quand deux ions ont le même rayon, c'est celui qui a la PLUS GRANDE charge qui est incorporé.
Si : 0,38Å et Al : 0,45Å
- Les feldspaths alcalins (orthoclases).
On remplace un Si par un Al dans un tétraèdre sur 4.
-> (SiO2)3AlO2K => feldspath potassique, « orthose », « samidine ».
-> (SiO2)3AlO2Na => feldspath sodique, « Albite ».
A 1000°C, on peut avoir un cristal mixte (NA et K présents) mais Na : 0,97Å et K : 1,33Å (plus de 15%). Quand la température devient inférieure à 600°C, ce cristal mixte ne peut plus exister et il va y avoir séparation de Na et de K : c'est le phénomène de démiction. Un cristal qui a subit une démiction est un cristal dans lequel des parties (tâches) appartiennent à un autre cristal (mélange) : ce sont les perthites.
- Les feldspaths calcosodiques (plagioclases).
-> Si2Al2O8Ca : feldspath calcique dans les roches volcaniques : l'Anorthite.
-> Les plagioclases sont dans certains cas, une série mixte avec du Ca et du Na à haute température. Ils ont une macle en alternance (bande noire, bande blanche observées en lumière polarisée analysée).
- Les feldspathoïdes.
-> Il y a remplacement d'un Si par un Al : Si2Al2O6K => la Leucite (retrouvée dans la lave du Vésuve).
-> SiAlO4Na : la Néphéline (minéral blanc et complexe des roches volcaniques).
=> Ces feldspathoïdes sont des roches à déficit en Si.
3\ Autres substances minérales
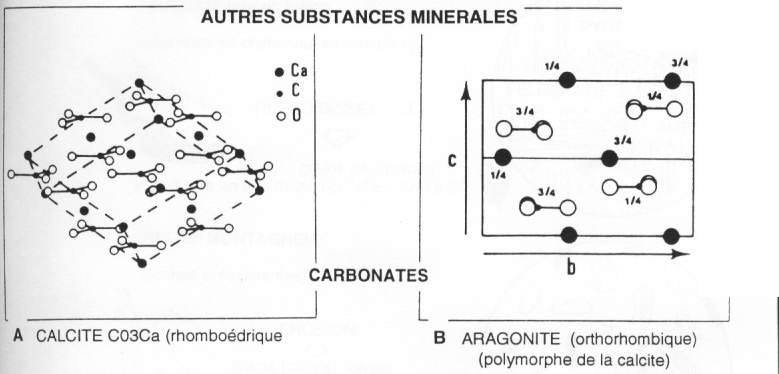
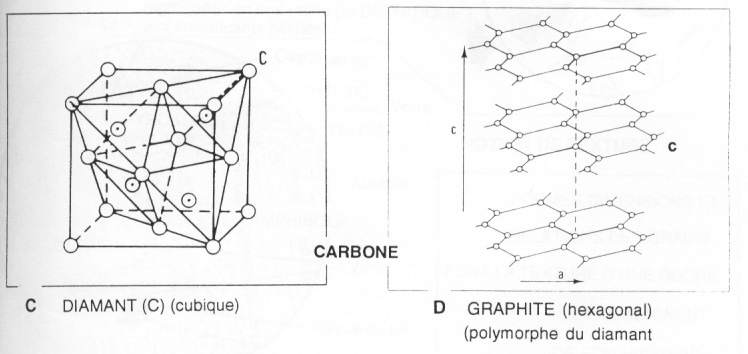
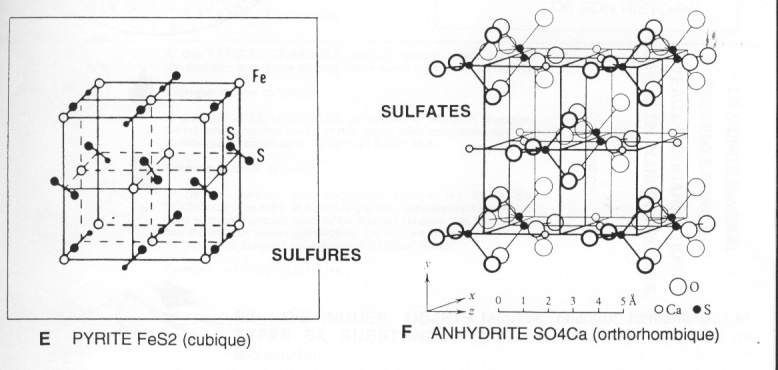
Les carbonates:
- La Calcite : rhomboèdrique, stable, densité = 2,7.
- L'aragonite : orthorhombique, d = 2,9, instable et pourtant c'est la plus facile à réaliser. A basse température, elle donnera de la calcite. L'aragonite constitue la coquille des êtres vivants. Après leur mort, ce minéral donnera de la calcite.
Le carbone:
- Le diamant : très dur, cubique. Il est souvent sous forme d'octaèdre/ On le retrouve dans les milieux HT, HP (haute température, haute pression), dans les vieux volcanismes.
- Le graphite : il est très tendre, polymorphe du diamant. Les liaisons dans un feuillet sont très dures mais entre les feuillets, l'attraction est très faible et provoque donc une fragilité. Il est retrouvé dans les roches de HP.
Le sulfure:
On citera la pyrite, de couleur jaune d'or, qui est retrouvée dans les roches métamorphiques. FeS2 est cubique.
Les sulfates (en SO4Ca):
Généralement orthorhombiques, les liaisons sont réalisées grâce au Ca2+ ; se retrouve dans les évaporites. Cette anhydrite peut s'hydrater pour donner du gypse. Quand ce dernier est déshydraté, il forme une poudre blanche qui réhydratée donne le plâtre. Le passage de l'anhydrite au gypse provoque une augmentation du volume où les lamelles glissent les unes par rapport aux autres. Ceci provoque l'instabilité des sols où elle est retrouvée